
从双孢菌中克隆到天冬氨酸蛋白酶基因并在毕赤酵母中表达。重组的BsAPA在pH 3.0和75℃的条件显示出最大活性,并在70℃及以下保持稳定,表明BsAPA具有热稳定性。但是,热失活仍然限制了BsAPA的应用。为了进一步提高其热稳定性,在BsAPA中鉴定了一个自催化位点(L205-F206),并基于对自催化位点附近结构的分析生成了三个突变体(F193W、K204P和A371V)。这些突变体具有改进的热稳定性,它们在75℃下的半衰期分别增加了0.5倍、0.2倍和0.3倍。一个三位点突变体(F193W/K204P/A371V)与野生型相比,其半衰期在80℃下增加了1.5倍,Tm增加了10.7℃。这些结果表明天冬氨酸蛋白酶的自催化作用降低了酶的热稳定性。此外,在自催化位点附近的区域进行定点诱变是提高天冬氨酸蛋白酶热稳定性的有效方法。
同源建模(Homology modeling)是利用信息技术的手段,可以直接从蛋白的一级结构(氨基酸序列)预测蛋白质的高级结构(主要为三级结构)。人们可以通过使用一个或多个已知结构的蛋白(模板蛋白,template)来构建未知结构蛋白(目标蛋白,target)的空间结构。Discovery Studio为用户提供了一整套利用Homology modeling方法自动预测蛋白质空间结构的工具。用户只需要提供蛋白质的氨基酸序列既可以轻松完成同源模型的构建及模型可信度评估的工作。
Ref:Journal of Agricultural and Food Chemistry. Accepted: August 29, 2019, IF=4.192
链接:https://pubs.acs.org/doi/10.1021/acs.jafc.9b03959
一、研究背景
天冬氨酸蛋白酶(EC 3.4.23)也称为酸性蛋白酶,在酸性条件下具有最佳的蛋白水解活性,该蛋白酶优先切割具有侧向疏水链的氨基酸残基的肽键。但大多数天冬氨酸蛋白酶不具有耐热性,只有在中等温度(40-60℃)时具有最大活性,因此探究热稳定的天冬氨酸蛋白酶在现代工业中具有较大的吸引力。同时,研究天冬氨酸蛋白酶的热稳定性机制至关重要。
基因工程和蛋白质工程被用于开发用于特定生物过程的天冬氨酸蛋白酶。基于机制提高酶热稳定性的方法包括引入二硫键、优化蛋白质表面电荷和提高构象的刚度。研究表明,使用分子修饰方法也可提高天冬氨酸蛋白酶的热稳定性,如位点特异性突变。蛋白酶自催化过程是温度驱动的,并且自催化作用与肽链的柔韧性有关,作用位点主要发生在表面区域。因此,蛋白酶自催化抗性和热稳定性相关。对类似嗜热菌蛋白酶的定点诱变研究表明,表面残基的突变可有效提高蛋白酶的热稳定性。
而本研究为了探究天冬氨酸蛋白酶的自催化反应与热稳定性之间的关系,从双孢酵母中克隆了高温天冬氨酸蛋白酶基因BsAPA,并对BsAPA的自催化位点的氨基酸进行了突变构建了与自催化位点相邻的突变体,验证BsAPA失活是由于高温下的自催化作用引起的。此外,作者为了探究突变体热稳定性提高的原因,采用同源建模和结构分析的方法研究突变体热稳定性的分子机理。
二、突变体的设计与筛选
作者首先将纯化的BsAPA蛋白在70或75℃下经过不同时间的孵育,并通过SDS-PAGE分析和PPSQ-33自动序列分析系统,对自催化产物氨基酸残基进行分析,然后确定了自催化位点是L205-F206,并且该位点位于蛋白质表面β-折叠和环之间的连接区(图1)。
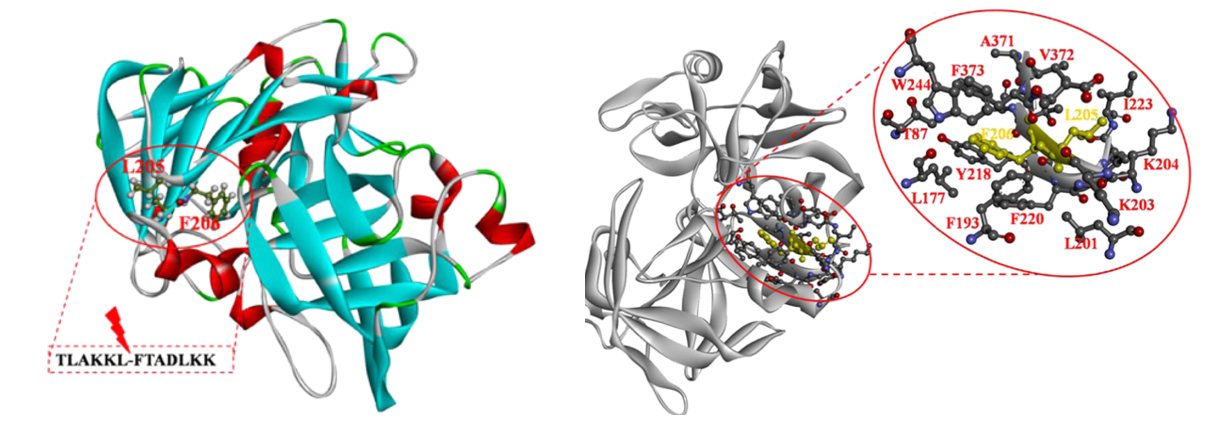
图1 BsAPA自催化位点的分析
由于增加邻近自催化位点的局部结构的稳定性是抵抗蛋白酶自催化的有效方法,所以作者选择了位于自催化位点5Å内的18个氨基酸残基进行诱变,包括T87,L177,F193,L201,K203,K204,L205,F206,Y218,G219,F220,G221,Y222,I223,W244,A371,V372和F373(图1),排除一些保守的氨基酸残基后,选择了七个非保守残基(F193,K203,K204,L205,G219,Y222和A371)进行定点诱变,总共构建了11个单点突变体,并将其转化到毕赤酵母中进行表达和纯化。结果表明F193W,K204P和A371V突变增加了热稳定性,并构建了F193W/K204P/A371V三重突变体,发现三重突变体比单位点突变体具有更高的热稳定性。
三、BsAPA突变体的结构和机理分析
为了探究突变体热稳定性提高的原因,作者采用了Discovery Studio 2017软件对其机理进行了分析,发现突变体热稳定性的增加原因是氨基酸残基之间的相互作用增强了。F193W型(图2B)与野生型(图2A)相比,F193W突变是通过改善了Trp193和Val148之间的烷基-π相互作用以及Trp193和Phe220之间的π-π堆叠相互作用。
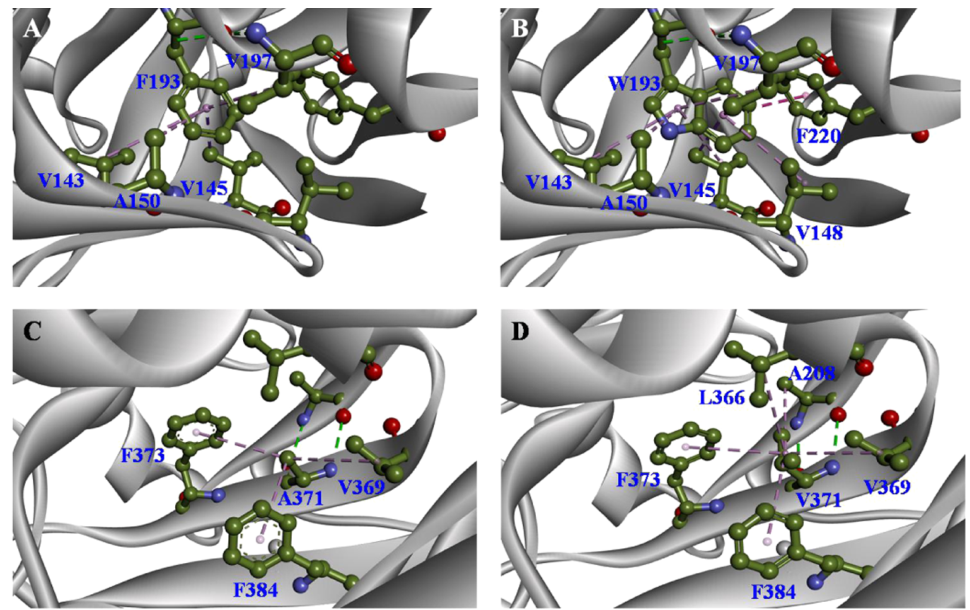
图2 野生型和突变型BsAPA酶的构象分析
突变体A371V(图2D)与野生型(图2C)相比,具有不同的疏水性排列方式,用庞大的疏水性缬氨酸替代弱疏水性丙氨酸可促进周围氨基酸残基之间的疏水作用,从而提高了BsAPA的热稳定性。疏水相互作用是负责蛋白质稳定性的主要因素,疏水性可驱动有效的蛋白质折叠并在高温下保持其结构,因此F193W和A371V取代对BsAPA热稳定性的影响是显而易见的。
四、结论
在这项工作中,作者成功克隆出天冬氨酸蛋白酶基因,并对自催化位点的氨基酸进行突变,然后构建一系列在不损失酶促活性的情况下可提高BsAPA的热稳定性的突变体。通过分子模拟的方法揭示了BsAPA中自催化作用与热稳定性之间的关系,并为提高天冬氨酸蛋白酶的热稳定性提供了新思路。
为什么选择Discovery Studio?
1. Discovery Studio 提供一整套同源建模的工具,使用DS,可以轻松完成所有的同源建模过程,你脑阔模板识别、序列比对、自动建模、模型的评估与优化;
2. Discovery Studio 中同源建模工具可以预测多种类型生物大分子的结构,包括:球蛋白、抗体、跨膜蛋白等;
3. Discovery Studio 中同源建模的核心程序是MODELER,该算法非常经典,引用率比较高。
4. Discovery Studio 应用广泛,操作简便,图形化界面十分友好,结果易于分析。