
促性腺激素释放激素(GnRH),也称为促黄体激素释放激素,是生殖系统的主要调节剂,通过与GnRH1受体(GnRH1R)结合而作用于促性腺激素细胞。 GnRH-GnRH1R系统是维持生殖功能的有希望的治疗靶点。迄今为止,市场上有许多靶向GnRH1R的疾病治疗配体。在这里,我们报告GnRH1R的晶体结构以2.8Å的分辨率与小分子药物elagolix结合。该结构揭示了一个有趣的N末端,可与elagolix共同占据扩大的正构结合位点。通过结构分析,功能测定和分子对接研究进一步研究了异常配体结合模式。另一方面,由于缺少胞质C末端螺旋的独特特征,GnRH1R表现出与其他A类GPCR不同的微开关结构特征。总而言之,这项研究提供了对GnRH1R配体结合模式的深入了解,并为合理的药物设计提供了一个框架模型。
能量优化(Minimization):BIOVIA Discovery Studio中可基于CHARMm等一系列力场,以及包含GBSW等多种不同类型的隐式溶剂模型,对蛋白质、核酸、多糖、多肽、小分子以及相应的复合物进行能量优化。
DS CDOCKER 是基于CHARMm的对接程序,采用soft-core potentials以及optional grid representation将配体分子与受体活性位点进行对接。
ref:NATURE COMMUNICATIONS | (2020) 11:5287 IF=12.121
链接:https://www.nature.com/articles/s41467-020-19109-w
在人类中,下丘脑-垂体-性腺(HPG)轴对于生殖和性特征的表达至关重要。 HPG轴的中央调节剂是促性腺激素释放激素(GnRH),一种由哺乳动物下丘脑神经元产生的十肽神经激素。 GnRH肽可以通过异三聚体Gq蛋白途径激活GnRH受体。这继而引发生殖激素级联反应并释放促性腺激素:促卵泡激素和促黄体激素。在与生殖疾病相关的生理和病理条件下均观察到GnRH脉冲模式的改变。人体内的GnRH肽有两种同工型,即GnRH-1和GnRH-II,其作用是通过激活经典的GnRH1受体(GnRH1R)发挥的,该受体属于视紫红质G蛋白偶联受体(GPCR)家族。 GnRH1R主要在垂体促性腺激素细胞上表达,但在淋巴细胞和乳腺,卵巢和前列腺细胞上也表达,并且已成为治疗不育症,子宫肌瘤,子宫内膜异位和前列腺癌的有希望的治疗靶标。近年来,已经开发出许多GnRH-类似物激动剂用于临床应用,其下调促性腺激素细胞上的相应受体并使之脱敏,从而抑制促性腺激素和性类固醇的分泌。此外,已经合成了可以立即阻断GnRH1R信号转导的GnRH类似物拮抗剂。由于与肽类药物相关的问题,包括稳定性差和半衰期短,迫切需要一种作用于GnRH1R的口服活性小分子药物,其中一些已从几种化学类别中脱颖而出,成为治疗生殖激素相关疾病的潜在途径。
Abbott Laboratories报告了第一个非肽GnRH1R拮抗剂。从那时起,已设计了各种非肽拮抗剂骨架,并将其成功地推进到不同的临床试验阶段。例如,elagolix(NBI-56418)是尿嘧啶的衍生物,已由美国Neurocrine Biosciences报道,并于2018年获得美国食品和药物管理局的批准,用于治疗与子宫内膜异位症相关的中重度疼痛。该药物也正在开发中,用于治疗女性子宫肌瘤和前列腺癌以及男性良性前列腺增生。日本武田公司开发了一系列噻吩并吡啶衍生物,包括sufugolix和relugolix,它们已进入子宫内膜异位症,前列腺癌和子宫肌瘤的临床试验。特别是,最近人们批准了relugolix在日本上市,以治疗与子宫肌瘤相关的症状。尽管在了解GnRH1R的生化和药理学特性方面取得了许多新进展,但是研究GnRH1受体与配体相互作用的分子机理仍然需要实验结构。
在本研究中,获得了人类GnRH1R与拮抗药elagolix的复合物的晶体结构。与其他GPCR相比,GnRH1R结构包含一个不寻常的正构位点,在该位点,该拮抗剂和该蛋白的N末端可共同占据一个扩大的结合口袋。为了进一步研究GnRH1R与非肽类拮抗剂的结合机制,使用BIOVIA Discovery Studio中的CDOCKER进行了分子对接计算,计算结果表明,GnRH1R的正构结合口袋相对于不同的配体具有可塑性,并且由于GnRH1R中的溶剂可及通道,提供了设计对受体具有活性的口服可递送小分子的可能性。
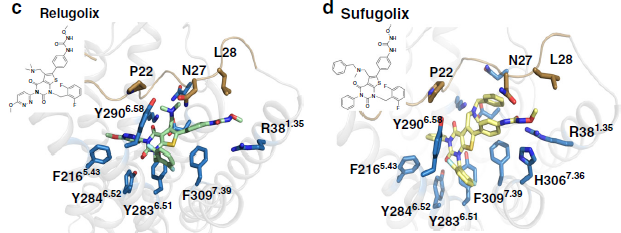
图一. 小分子拮抗剂与受体之间的结合模式
为什么选择 BIOVIA Discovery Studio?
1. DS CDOCKER 首先采用高温动力学的方法随机搜索小分子构象,随后采用模拟退火的方法将各个构象在受体活性位点区域进行优化,从而使对接结果更加准确;
2. BIOVIA Discovery Studio 中可基于CHARMm等一系列力场进行能量计算及能量优化;
3. BIOVIA Discovery Studio 应用广泛,操作简便,图形化界面十分友好,结果易于分析。