
声明:本文翻译自Certara公司网站。
原文链接:https://www.certara.com/app/uploads/2020/06/CS_IntegratingPKModeling.pdf
原发性胆道胆管炎(Primary Biliary Cholangitis, PBC)是一种以胆汁淤积胆汁酸浓度增加导致肝损伤为特征的慢性、罕见疾病【1】。未经治疗的PBC可导致肝衰竭和死亡。目前唯一批准的PBC治疗方法是熊去氧胆酸(Ursodeoxycholic Acid, UDCA)。然而,并不是所有患者都对UDCA有反应。Intercept制药公司——一家新兴的全球生物制药公司——试图开发奥贝胆酸(Obeticholic Acid, OCA)作为PBC的替代疗法。OCA是初级胆汁酸鹅去氧胆酸的半合成类似物,具有相似的药代动力学(PK)特性。像其他胆盐一样【2】,OCA通过与甘氨酸和牛磺酸结合被代谢。OCA是一种选择性和有效的法尼酯X受体(Farnesoid X receptor, FXR)激动剂【2】,FXR的活化可降低肝脏中胆汁酸浓度,减少细胞损伤。FGF-19被用作OCA药理活性的生物标志物。
挑战
Intercept制药公司需要开发一种奥贝胆酸(OCA)的给药策略,用于治疗原发性胆道胆管炎(PBC)患者。
解决方案
Certara科学家使用Phoenix NLME建立了一个生理PK模型来定义有或无肝损害的PBC患者OCA全身和肝脏暴露之间的关系。
收益
建模结果证实了OCA给药方案对PBC患者的安全性和有效性。
因为肝损害是PBC患者疾病进展的结果,Intercept团队需要开发一种有或无肝损害的PBC患者OCA的剂量策略。他们进行了一项小型临床研究,在健康志愿者和轻度、中度和重度肝损害患者中给予单剂量OCA,并进行了24小时的高强度PK采样研究【2】。
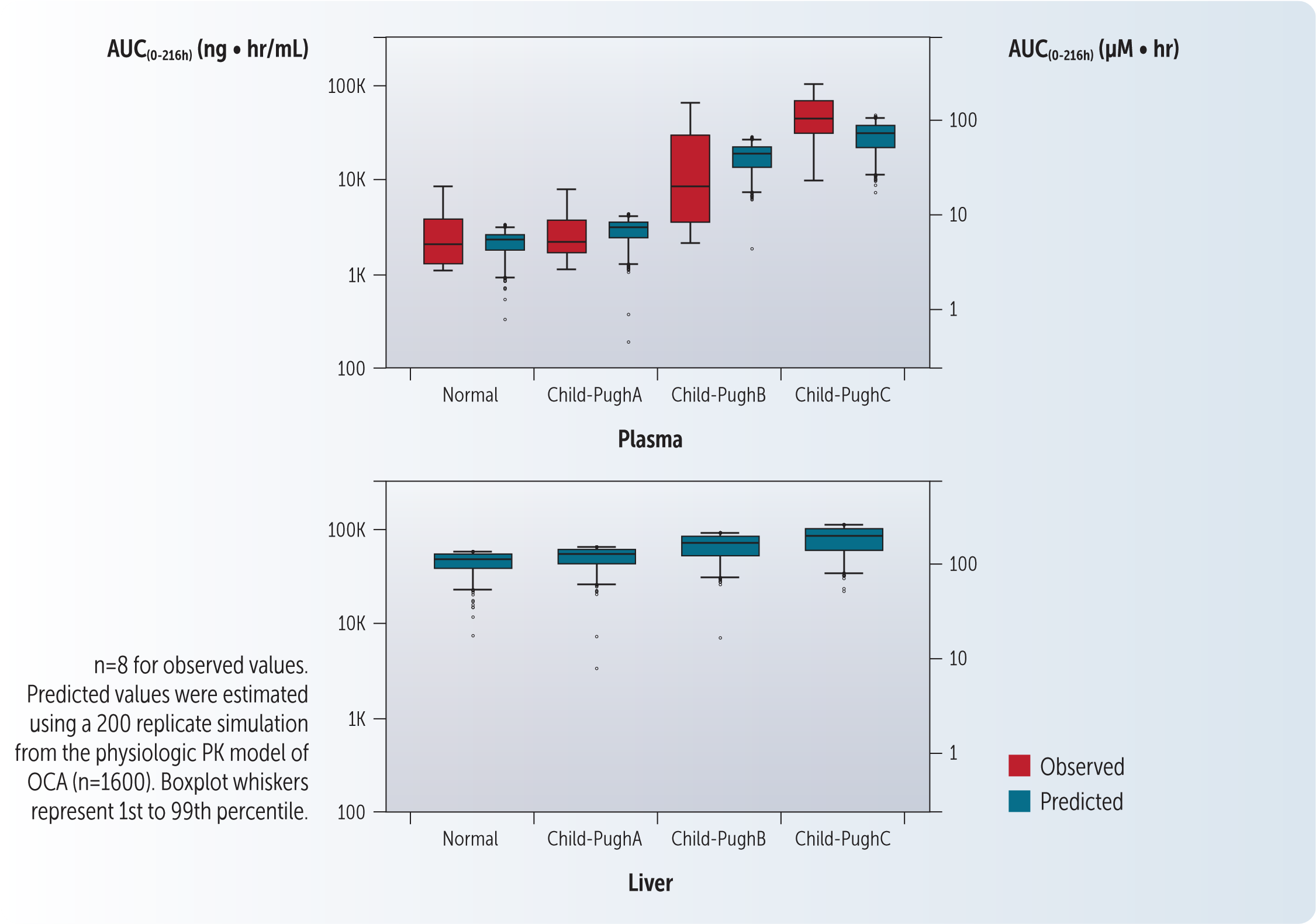
结果显示,系统OCA浓度随着肝损害的加重而增加【2】。然而,血浆FGF-19水平随着OCA的使用而增加,对于有肝损害和没有肝损害的受试者,这表明FXR的激活。显然,单纯看OCA的全身暴露水平不能对应其在肝脏中的药理作用。制定一个强有力的给药策略需要了解在有肝损害和没有肝损害的患者中OCA的全身和肝脏暴露的关系。
Certara科学家们使用自己的群体PK/PD建模软件Phoenix NLME来进行机制建模和模拟【1, 2】。该模型是基于先前报道的鹅去氧胆酸模型【3】,在接受单剂量OCA的健康志愿者中,使用OCA、glyco-OCA(和甘氨酸形成的共轭体)和tauro -OCA(和牛磺酸形成的共轭体)的血浆浓度-时间数据校准OCA模型。然后,使用单次服用OCA的肝损害患者重新校正模型。肝功能损害涉及以下机制: OCA及其代谢物的肝脏更新减少,门脉系统分流,功能性肝体积减少,牛磺酸偶联增加。
当发现其预测的OCA-血浆暴露量与健康志愿者和肝损伤患者观察到的暴露量相当时,即生理PK模型得到了验证【2】。模型和临床数据均显示,在肝损伤患者中,全身OCA暴露量显著增加。然而,与健康志愿者相比,OCA的肝脏暴露在轻度、中度和重度肝损害患者中仅略有增加。建模结果和临床试验数据支持OCA给药策略的安全性和有效性。只有中、重度肝损害的PBC患者才需要减少剂量【1, 4】。
2016年5月,美国FDA批准Ocaliva (Obeticholic Acid)联合UDCA治疗那些单用UDCA响应不佳或者UDCA不耐受的成年人PBC的治疗【5】,它也是近20年来批准治疗PBC的第一个新药。
由于Ocaliva有潜力解决目前未满足的医疗需求,FDA授予其快速通道认证【5】。Ocaliva还获得了孤儿药称号,这使其赞助商有权获得税收抵免、用户费用减免和市场排他性权利。Ocaliva的案例表明,赞助商可以通过定量药理建模来加速药物审批。
血浆OCA浓度不能很好地替代肝脏OCA浓度
参考资料
1. U.S. Food and Drug Administration. Clinical Pharmacology Review – Ocaliva.
http://www.accessdata.fda.gov/drugsatfda_docs/nda/2016/207999Orig1s000ClinPharmR.pdf
2. Edwards J, LaCerte C, Peyret T, Gosselin NH, Marier JF, Hofmann AF, and Shapiro D. Understanding the Relationship between Systemic and Hepatic Exposure of Obeticholic Acid for the Treatment of Liver Disease in Patients with Cirrhosis. Presented at the American Association for the Study of Liver Diseases Liver Meeting. November 13-17, 2015, San Francisco, CA.
3. Molino G, Hofmann AF, Cravetto C, Belforte G, Bona B. Simulation of the metabolism and enterohepatic circulation of endogenous chenodeoxycholic acid in man using a physiological pharmacokinetic model. Eur J Clin Invest. 1986;16(5):397-414.
4. U.S. Food and Drug Administration. Full Prescribing Information – Ocaliva
http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/207999s000lbl.pdf
5. U.S. Food and Drug Administration. FDA News Release: FDA approves Ocaliva for rare, chronic liver disease. 31 May 2016.
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm503964.htm