
转染过程中重排(RET)是一种受体酪氨酸激酶,由胶质细胞系衍生神经营养因子家族配体激活。在乳头状甲状腺癌和髓样癌患者中观察到RET的染色体重排或点突变。RET的致癌改变导致RET活性的结构性激活。因此,抑制RET活性已成为甲状腺癌治疗的靶点。在这里,一种新的RET抑制剂在髓样甲状腺癌细胞中的抗肿瘤活性被表征。测定了靛玉红衍生物LDD-2633对RET激酶的抑制活性,在体外,LDD-2633对RET激酶有很强的抑制作用,其IC50值为4.42 nM。LDD-2633可通过抑制细胞增殖和诱导凋亡来抑制RET突变的TT甲状腺癌细胞的生长。检测LDD-2633对RET信号通路的影响:LDD-2633抑制RET蛋白及其下游分子Shc和ERK1/2的磷酸化;口服LDD-2633 20或40 mg/kg可剂量依赖性地抑制TT细胞移植瘤的生长。体内实验结果支持LDD-2633作为甲状腺癌抗癌药物的潜在用途。
分子对接(Molecular docking)是基于结构药物设计的核心模拟手段,依据受体与配体作用时的几何匹配和能量匹配过程,模拟受体-配体相互作用,预测两者间最佳的结合模式和结合亲和力。采用分子对接模拟技术,科研人员可以进行基于结构的药物虚拟筛选,药物分子的结构改造,配体和受体相互作用的机理研究等工作,从而大大提高实验效率。在BIOVIA Discovery Studio这一分子模拟的综合平台中,分子对接程序包含Libdock、CDOCKER、Flexible Docking,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求,为其提供配体受体间相互识别的“利器”。
ref:Pharmaceuticals 2021,14, 38;IF=4.286
链接:https://doi.org/10.3390/ph14010038
甲状腺癌主要分为三种组织学类型:分化型、髓样型和间变性癌。组织学分化型甲状腺乳头状癌(PTC)是最常见的甲状腺癌类型,约占所有甲状腺恶性肿瘤的80%。甲状腺髓样癌(MTC)起源于降钙素产生细胞,约占所有甲状腺恶性肿瘤的4%。甲状腺癌的主要治疗方法是手术治疗,分化型甲状腺癌可采用放射性碘治疗作为辅助治疗。美国分化型甲状腺癌患者的10年生存率很高,也就是90%以上。然而,对于放射性碘难治的分化型甲状腺癌患者来说,10年生存率不到10%。对于不能切除、进展性和转移性的MTC,中位10年生存率为40%。甲状腺癌的治疗仍然具有挑战性,利用小分子抑制剂进行靶向治疗是一种有前景的治疗选择。在甲状腺癌和甲状腺癌中都有RET的致癌改变的报道,因此,RET蛋白已成为甲状腺癌治疗的一个有前途的靶点。
RET原癌基因编码一种跨膜受体酪氨酸激酶,参与多种癌症的发生。在正常细胞中,RET激酶被胶质细胞系源性神经营养因子(GDNF)家族配体激活。这些配体并不直接与Ret结合;相反,它们的结合是由一个辅助受体介导的:胶质细胞源性神经营养因子家族受体-α。在RET激酶激活后,信号由信号转导通路介导,如丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3-激酶通路。RET蛋白的致癌改变是由染色体重排或RET序列突变引起的。染色体重排导致RET激酶结构域中的蛋白与配对蛋白融合。在癌症中,通常发现的融合蛋白是含有6-RET、核受体辅活化子4-RET和Kinesin家族成员5B-RET的盘绕结构域。RET蛋白的嵌合融合通过先前研究中描述的机制导致RET激活。其他形式的致癌基因RET改变是点突变,如M918T或A883F,在没有配体刺激的情况下导致RET激活。RET的染色体重排通常见于PTC,而点突变通常见于MTC。
基于这些观察,RET已成为甲状腺癌治疗的一个有吸引力的靶点,因此,RET抑制剂已被积极研究。几种RET抑制剂已经被食品和药物管理局(FDA)批准用于甲状腺癌治疗。Vandetanib、Cabozantinib、lenvatinib和sorafenib是具有RET抑制活性的多激酶抑制剂,已被重新用于甲状腺癌的治疗。最近,选择性RET抑制剂selpercatinib和pralsetinib(BLU667)被批准用于几种适应症,包括RET突变型MTC。RXDX-105和TPX-0046目前正在接受调查。
据报道,含有靛玉红核心骨架的化合物可以抑制激酶。不同的激酶会受到靛玉红衍生物的影响,这取决于靛玉红核心骨架的化学修饰。被这些衍生物抑制的激酶包括糖原合成酶激酶3β、细胞周期蛋白依赖性激酶、双特异性酪氨酸磷酸化调节激酶和极光激酶。我们小组之前也报道了靛玉红30-肟衍生物作为有效的CDK2和FMS样酪氨酸激酶3(FLT3)抑制剂。靛玉红-30-肟衍生物的这些特性及其作为激酶抑制剂的功能使我们评估了它们的RET抑制功能。在本研究中,靛玉红衍生物LDD-2633被鉴定为一种新型的RET抑制剂,对MTC具有抗癌活性。LDD-2633在MTC细胞系TT的体外表现出RET激酶抑制活性。此外,LDD-2633对TT细胞的生长有抑制作用,这与观察到的抑制RET活性的结果一致。LDD-2633在小鼠TT细胞移植瘤中也显示出抗肿瘤作用。这些结果表明LDD-2633有可能成为治疗甲状腺髓样癌的抗癌剂。
用RET重组蛋白对靛玉红衍生物LDD-2633进行体外RET激酶活性测定。LDD2633具有较强的抗RET激酶活性,IC50值为4.42±0.0899 nM。为了更好地了解LDD-2633的结合机制,我们利用磷酸化的RET酪氨酸激酶结构域(PDB代码:2X2K)的X射线晶体结构进行了对接研究。LDD-2633是在BIOVIA Discovery Studio 程序中使用CDOCKER对接的。对接结果表明LDD-2633成功对接到ATP结合位点。图1显示了前10个LDD2633对接位置中最稳定的绑定模式。靛玉红核心骨架与Ala807和Lys808残基的主链羰基形成两个标志性的氢键。在靛玉红骨架的羰基部分和铰链区Tyr806残基的酚基部分之间形成了两个额外的氢键。乙基哌嗪部分占据了Asp-Phe-Gly(DFG)基序移动产生的内袋,并与位于DFG基序中的Asp892残基显示出较强的氢键。根据这些结果,我们推测LDD-2633对RET活性的直接抑制是通过与RET激酶的ATP结合位点相互作用而实现的。
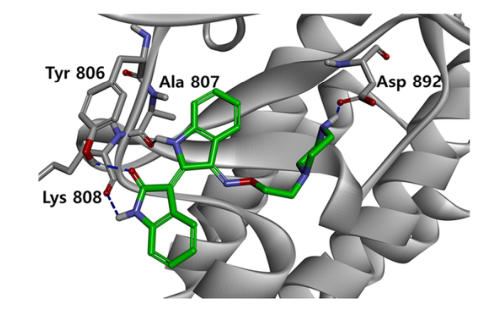
图1:LDD-2633和RET的结合方式
为什么选择 BIOVIA Discovery Studio?
1. BIOVIA Discovery Studio 中共有四种对接程序,这四种对接算法各有优势,能够满足广大科研工作者的多种应用需求;
2. BIOVIA Discovery Studio 中有多种对接结果的评价分析手段,包括2D/3D相互作用图分析(可以分析氢键、疏水作用、卤键等多种非键相互作用类型)、结合口袋表面分析、氢键热图、多种打分函数、结合能的计算等;
3. BIOVIA Discovery Studio 应用广泛,操作简便,图形化界面十分友好,结果易于分析。